光动力治疗(pdt)是一种通过光敏剂产生活性氧来诱导癌细胞凋亡的癌症治疗方法,可对多种癌症进行非侵入性治疗。由于肿瘤早期表现出特定microrna(mirna)的异常高表达,mirna响应激活的光敏剂在光动力治疗中引起关注。然而,体循环中的rna会在负载光敏剂的纳米探针到达肿瘤细胞前引起非特异性激活,引起对正常组织器官的毒副作用。因此,开发外部开关来调控mirna响应的光敏剂激活,是实现精准pdt的关键。
上转换纳米粒子(ucnps)可以在近红外光下发射紫外/可见光。我校生命分析化学国家重点实验室鞠熀先教授研究团队近年来利用ucnps的这一性质,提出了用于癌症基因治疗的上转换纳米胶囊(biomaterials 2018, 163, 55)与上转换纳米"洋葱"(biomaterials 2019, 225, 119501)、化疗的偶氮苯-dna纳米泵(angew. chem. int. ed. 2019, 58, 18207)和pdt的"能量集中域"策略(angew. chem. int. ed. 2019,58, 12117),提升了ucnps的能量转移效率与发光强度,改善了癌症基因治疗、化疗和pdt的治疗效率。
近期,该研究组针对体循环中rna干扰mirna响应激活光敏剂的问题,利用其设计的光响应性dna纳米梳,研制了一种近红外光调控的mirna放大器,并结合ucnps的近红外光激发、多短波长发射的性质实现了早期癌症的精准光动力治疗。dna纳米梳由"光拉链"保护的发夹h0和特定的发夹h1与h2交替组装在长链dna骨架上构成,它通过共价连接修饰在核壳ucnps(nayf4:tm,yb,gd@nayf4:nd,yb)表面(图1)。三种发卡均标记有光敏剂ppa'(焦脱镁叶绿酸-a的衍生物)以及对应的猝灭剂(bhq)。在808 nm激光照射下,ucnps发射出紫外光,切断"光拉链"使其脱落,从而暴露出mirna-21识别区域。该区域在癌细胞过表达的mirna-21作用下发生级联杂交反应,放大激活发卡中修饰的光敏剂ppa',在ucnps同时发射的蓝光激发下产生活性氧,以实现早期癌症的高效精准pdt。体外实验证明,"光拉链"可成功封闭mirna-21的识别区域,在近红外光下,mirna-21可以有效触发级联杂交反应及其放大效应。细胞与活体实验证明,该mirna放大器可以有效抑制癌细胞的增殖以及小鼠体内早期肿瘤的生长。因此,该策略在早期癌症的精准治疗中具有很好的应用前景。
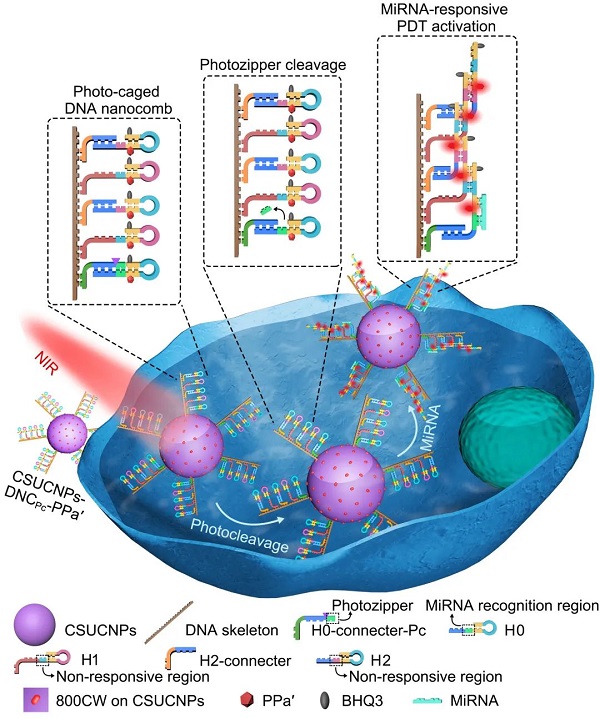
图1. 近红外光调控的mirna放大器对早期癌症的精准pdt原理图。
上述相关成果已以“near-infrared photo-switched microrna amplifier for precise photodynamic therapy of early-stage cancers”为题于8月14日在angew. chem. int. ed.(doi: 10.1002/anie.202009263)在线发表。博士生张玥和研究助理陈伟伟为该工作的共同第一作者,鞠熀先教授和刘颖教授为共同通讯作者。

